电话:400-022-6665
传真:022-27401850
地址:天津市南开区卫津路92号天津大学北门填料大楼1层
邮编:300072
网址:http://m.ayzxls.com
以上通用技术方法的标准虽然尚在研究阶段,但是代表了未来我国药品标准的发展方向,相关仪器企业及应用单位,可以密切关注方法标准研究及落地进展,在通用技术方法落地实施前采取应对措施。
近日,国家药典委官网发布了《关于做好2023年度国家药品标准提高工作的通知》。根据通知,本次标准提高工作,共有159个药品品种标准挺高项目课题,80个通用技术要求标准提高项目课题。
新标准历来是行业的方向标,不断提升药品标准,将有利于制药行业更好地升级发展。本次公布的80个通用技术要求课题中涉及多项科学仪器及检测技术相关内容。包括对《中国药典》已有的技术方法进行更新,引入新的检测技术和方法等。仪器信息网对相关内容进行了梳理,希望能够帮助大家了解药品标准提高方向,在通用技术方法落地实施前采取应对措施。
一、拟提高标准的80个通用技术方法概述按照国家药典委员会《药品标准制修订研究课题管理办法》(以下简称“管理办法”),经公开征集课题建议及承担单位、组织专业委员会及专家组审议、网上公示、药典委审核等程序,确定了2023年度国家药品标准提高任务。本次80个通用技术要求中,涉及中药8个、生物制品9个、药用辅料7个、理化分析17个、生物检定1个、微生物4个、制剂15个、药包材16个、标准物质3个,类别如下表所示:
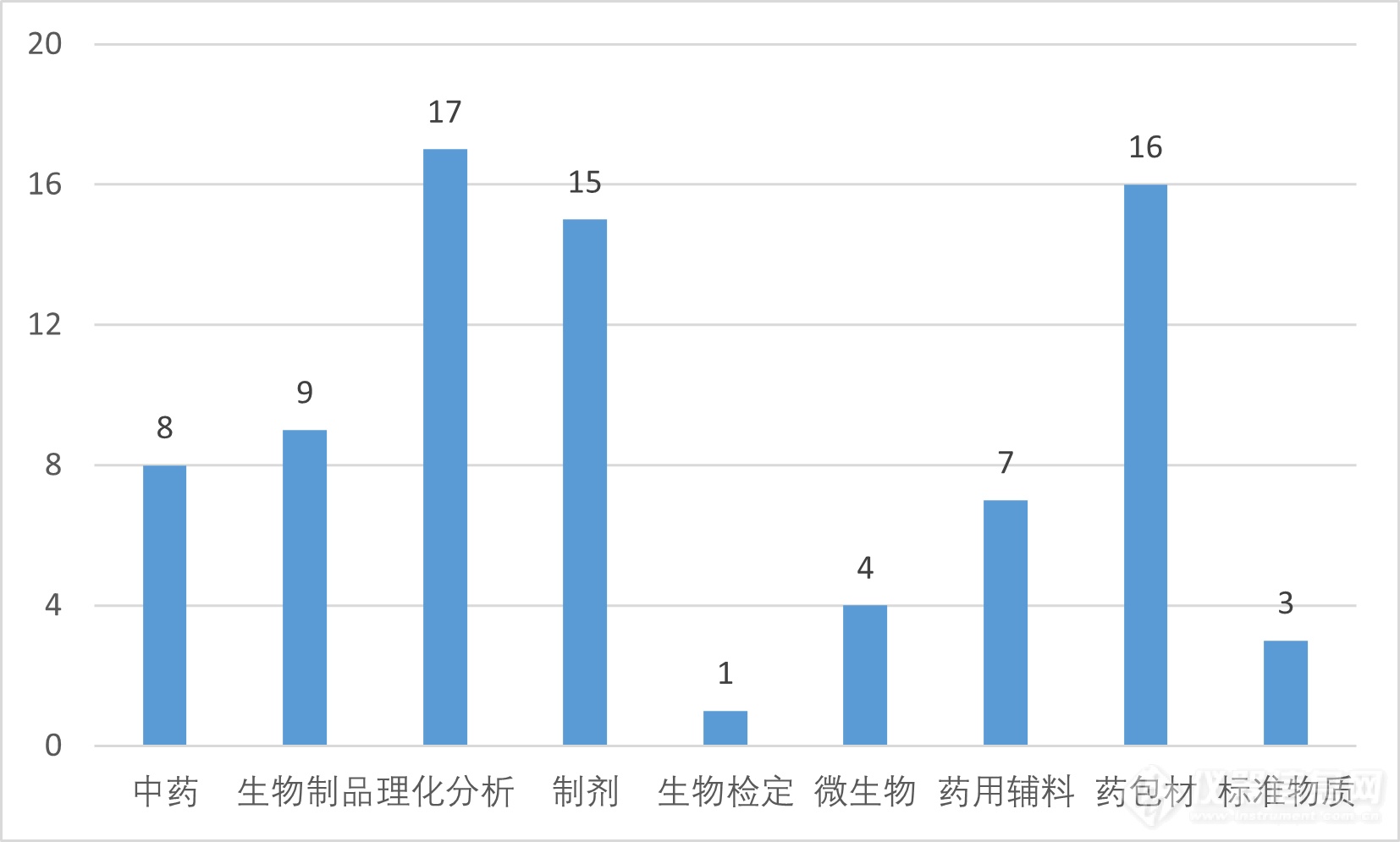
今年的17个理化分析相关课题,涉及多个《中国药典》四部的分析方法的建立及修订。其中拟新增或研究的方法6个,对原有分析方法修订11个,囊括天平、核磁共振波谱、红外光谱、近红外光谱、离子色谱、质谱等众多仪器方法。
制定《中国药典》四部天平与称量指导原则。为在药品质量研究、药品生产质量控制和药品检验中选择天平,校正、校准天平和确证天平性能,正确使用天平和规范称量,以及其中的关键要素提供科学规范和依据。
1. 法规研究:全面收集、梳理全球范围内权威机构对“称量与天平”相关的法规、技术要求、指导原则以及研究性论文等文献。
2. 称量操作研究:从称量操作的角度,结合药物分析实验自身特点,对重点内容进行文献对比研究,通过对生产和使用单位调研,摸清现阶段对于称量操作的总体认知和执行状况,了解行业内面临的痛点和难点。
3. 天平使用研究:从天平使用的角度,结合药物分析实验自身特点,对重点内容进行文献对比研究,通过对生产和使用单位调研以及不同品牌仪器和不同实验室的验证实验,摸清现阶段生产与使用单位的总体认知和状况,从理论和数据方面为合理制定指导原则提供基础。
4. 指导原则研究:对起草中国药典“称量与天平”相关指导原则的构架和内容进行研究和确定。通过前三项基础研究工作,充分总结我国行业现状,明细与全球主流和先进行业规范的差距,并结合我国国情逐一分析合理性和可行性,起草指导原则。
制定《中国药典》四部水活度(water activity,aw)测定法,阐述其检测原理、适用范围、仪器装置以及检测方法等,旨在为水活度在药品领域的检测应用提供指导。
修订《中国药典》四部0441核磁共振波谱法,提高方法的先进性及对实际应用的指导性,更好地满足我国药品研发、生产、监管的需求。开展仪器及测定方法的关键参数、定量核磁、方法验证、二维核磁、固体核磁、低场核磁等的研究。
1. 文献及资料调研:对现行版美国药典、欧洲药典、日本药典进行更新检索,对其收载的核磁共振波谱法相应章节与我国药典进行详细比对,明确我国药典相应方法通则的差距与欠缺;查阅近年具有影响力的SCI期刊文献,掌握拟新增和修订内容(如固体核磁、方法验证、定量核磁)的前沿进展与实际应用。
2. 开展实验研究:实验研究主要围绕固体核磁与方法验证两方面展开,①固体核磁部分:选择3-5种药物,制备获得其不同晶型与共晶物质作为实验样品,开展固体核磁共振研究;②方法验证部分:依托3-5个药物品种,开展定性定量方法学确认与验证研究。
3. 拟定方法修订草案:在文献资料调研与实验研究的基础上,完善补充必要术语、关键参数等文字内容,增订固体核磁、方法验证等技术内容,形成符合2025年版《中国药典》四部通则要求的“0441 核磁共振波谱法(修订草案)”。
修订《中国药典》四部0441质谱法,提高方法的先进性及对实际应用的指导性,更好地满足我国药品研发、生产、监管的需求。
1. 开展色谱-质谱联用技术用于微量、痕量风险性杂质或有效成分的定性、定量测定的适用性及规范性要求研究;2. 开展生物大分子药物、高聚物等质谱分析的关键点研究;3. 开展质谱法以及联用法的验证要求研究。
修订《中国药典》四部0982粒度和粒度分布测定法激光光散射法,调研目前不同品牌仪器的原理、操作参数的设置,使其内容与仪器的发展相适应,与我国实际应用情况相匹配,更好地指导方法的应用。
考察仪器硬软件、代表性样品(原辅料溶解性、原辅料粒径、制剂类型、制剂粒径)、方法变量和环境变量对测试方法、操作参数、测试结果的影响,制定适用于不同类型样品和不同类型原理仪器的粒度测定激光光散射法通则。
修订《中国药典》四部原子量表,与国际上最新的原子量表统一。参照IUPAC国际原子量表和国内相关标准,对各国药典原子量表进行比较,修订《中国药典》中的原子量表及表述,同时评估修订后对药典、检验等方面的影响。
1. 文献查阅:对IUPAC、各国药典以及国内相关标准有关原子量的确定以及表述进行详细研究,比较IUPAC最新原子量表和各国药典原子量的收载情况。
2. 修订:参照IUPAC国际原子量表,修订《中国药典》中原子量表及表述。研究是否新增元素。
3. 评估:根据比较结果,查找中国药典与IUPAC和国外药典的差别,并分析和评估这些差别对药典、检验等方面可能带来的影响。
鉴于蛋白质组学在药物质量控制方面的独特优势,针对蛋白质类、多肽类等药品的生产、质控要求,开展《中国药典》四部蛋白质组学分析方法及应用指导原则的研究,为蛋白质类等药物的定性、定量分析与质量控制提供新方法。
1. 基于质谱技术开展3种有代表性的重组蛋白类药物、多肽类药物在分子量测定、氨基酸一级序列覆盖率、和翻译后修饰研究的技术要素文献调研,进行重要技术要素的必要实验研究,确定分子量测定、肽谱(氨基酸一级序列覆盖率、翻译后修饰)分析的基本技术要求、需要考量的关键因素、质谱分析数据质量、鉴定结果可信度的基本要求,规定基本可接受标准。
2. 基于蛋白组学质谱技术开展3种有代表性的重组蛋白类药物、多肽类药物在HCP杂质发现、鉴定和定量分析的技术要素研究。调研与探索HCP杂质分析需要考虑的色谱质谱分析条件、质谱分析数据质量、鉴定结果可信度的基本要求。
结合我国药品释放度检查的实际情况,参考国外药典和相关指导原则,制定《中国药典》四部0931溶出度与释放度测定法浸没池法的仪器装置、测定法及结果判定标准。
1. 文献及相关资料调研:通过文献查阅和收集国外药典相关标准,了解国内外浸没池法应用现状及指导原则或药典中的相关规定,比对国际主流药典相关的仪器参数和技术要求。
2. 开展典型药品的浸没池法溶出度研究:选取2-3种具有代表性的外用半固体制剂,开展浸没池法溶出度试验研究,考察并确定实验关键参数。为制订浸没池释放度测定法指导性操作规程提供数据支持。
3. 在文献调研和实验研究的基础上,拟定《中国药典》四部通则0931 溶出度与释放度测定法浸没池法的仪器装置及测定法(草案)。
参考各国药典中溶液电导率测定法的相关内容,结合我国实际应用情况,制定《中国药典》四部溶液电导率测定法通则。
1. 建立标准测定方法,介绍电导率测定法的原理、计算公式,电导率仪器结构,电池常数的测定,温度补偿,电极的校准,液体的电导率测定等内容。
2. 考察目前国内各品牌电导率仪的结构、电极等质量现状,考察各相关品种标准中收载电导率项目的可行性;考察不同标准溶液对仪器测定结果的影响,明确对分析仪器的要求;考察不同温度及不同pH值对仪器测定结果的影响,明确对分析仪器的要求;建立校正仪器用的一系列不同浓度氯化钾标准溶液。
在对光学显微镜调研、各国药典标准比对和梳理《中国药典》通则中各检测方法对光学显微镜的不同要求基础上,制定《中国药典》四部光学显微镜法,阐述仪器种类、检测原理、适用范围、仪器装置、仪器校准等,规范描述粒子的基本特征语言,如粒径表征、形状表征、表面特性等。
1. 进一步完善国外药典及相关法规的对比工作,在已完成的光学显微镜法国外药典翻译的基础上,进一步整理与光学显微镜相关的国内外法规及应用内容,梳理国内外行业标准中光学显微镜的参数要求和应用异同点,查漏补缺。
2. 开展光学显微镜的市场调研,汇总光学显微镜的种类、特点及适用范围,比较各品牌显微镜数码成像系统的特点和操作优势等。
3. 开展光学显微镜基本构造研究。系统归纳符合中国药典应用需求的光学显微镜的机械构造,光源、反光镜、聚光器等光学部件和成像系统的分辨率等参数要求。并参考国内外显微镜行业标准要求确定中国药典光学显微镜的校准和测量技术要求。
4. 整理和分析各品种试样粒子的特性,系统梳理国外药典光学显微镜法、ISO/9276和国家标准GB/T15445.2-2006关于粒度分析结果的表述语言,验证典型试样的表述结果,规范中国药典中原料药、药物制剂等测量的粒子尺寸、形态特征等描述性语言。
修订《中国药典》0981结晶性检查法,对现有文字表述进行修订。选择典型结晶性药物品种,开展基于红外光谱法、拉曼光谱法在结晶性检查中的应用研究,增订红外光谱法、拉曼光谱法的应用描述。
1. 文献调研:对现行国外药典收载的技术方法进行比对,比较各自方法的优缺点和适用范围;结合目前已经发表的高水平SCI期刊论文的相关试验过程及结果,总结其采用方法的关键点及注意事项。
2. 方法建立:综合文献调研结果,并结合前期研究结果初步建立基于红外光谱法和拉曼光谱法的“结晶性检查法”。
3. 方法验证:选取《中国药典》中收载的8-10种药典收载药物品种的不同晶型物质(含晶态和无定型态),按照2.2中建立的方法,根据《中国药典》分析法验证的相关内容,充分考虑影响实验结果的实验设备参数的选择,开展系统的方法学研究和验证工作,并形成基于红外光谱法和拉曼光谱法的“结晶性检查法”草案。
4. 样品检测:(1)课题将选取8-10种药典收载药物品种,以其不同晶型物质状态样品(每个样品均包含晶态和无定型态),根据建立的基于红外光谱法和拉曼光谱法的“结晶性检查法”草案,开展相应的实验样品检测,为建立的草案积累实验数据。(2)结合固体药物研发技术的前沿热点,选取8-10种药物晶态和无定型态物质,开展固态核磁共振波谱法关于结晶性检查的探索性研究,为目前药物结晶性检查法收录更多定量的检测分析技术,提供相关研究方法与基础数据。
5. 方法完善:根据课题实验结果的综合分析,补充、完善建立的基于红外光谱法和拉曼光谱法的“结晶性检查法”,增加并细化测定过程的关键因素,并给出技术方法应用说。